Ķīmija ir daudzveidīga zinātne ar daudzām sadaļām, ko var izpētīt. Tā nav paredzēta tikai tiem, kas interesējas par zinātni! Ķīmija ir priekšmets, ko var mācīties gan vidusskolā, gan universitātē kā daļu no turpmākās izglītības. Daži izvēlas padziļināti apgūt vielu uzbūvi un pamatzināšanas ķīmijā, jo tiem patīk šie pamatjēdzieni un viņi vēlas paplašināt savas zināšanas. Citiem šis priekšmets ir bijis obligāts vidusskolas gados.

Patiesībā ķīmijas apguve ir prasme, ko daži apgūst ar prieku, bet citi – ar grūtībām. Ne visi novērtē zinātni, kas saistīta ar elementu, atomu, molekulu un jonu pētīšanu. Izpratne par to vielu uzbūvi, struktūru, īpašībām un uzvedību vienam var būt aizraujoša, bet citam – izaicinoša.
Ķīmija ir vielu pētīšana, bet es labāk to uztveru kā pārmaiņu pētīšanu.
Volters Vaits
Pamatzināšanas ķīmijā sniedz daudz priekšrocību, jo ķīmija tiek dēvēta par centrālo zinātni – tā apvieno matemātiku, fiziku, bioloģiju un medicīnu. Ķīmijas joma ir plaša, ar daudzām praksēm un tēmām, kas spēj dziļi ieinteresēt jebkuru zinātnes entuziastu. Šajā rakstā tiks aplūkoti daži pamatzināšanas ķīmijā jēdzieni, piemēram, ķīmiskās reakcijas, elementi, Levinsa struktūra, periodiskā tabula un šķidrumi un gāzes, lai sniegtu jums pārskatu par svarīgākajiem konceptiem. Nav svarīgi, vai jūs mīlat zinātni vai nē – šis raksts sniegs jums pamatzināšanas ķīmijā un ļaus justies pārliecināti, ja tēma tiks pieminēta sarunā.
Ķīmiskās reakcijas un vielu uzbūve

Ķīmiskās reakcijas notiek visu laiku. Vai jūs gatavojat ēdienu, kurināt uguni vai pat elpojat – visur rodas ķīmiskas reakcijas.
Ķīmiskajā reakcijā molekulas vai joni tiek pārkārtoti un veido jaunu struktūru. Atomu kodols paliek nemainīgs, un tikai elektroni tiek pārvietoti, veidojot ķīmiskās saites. Atomu skaits no iesaistītajiem elementiem nemainās – tas paliek tas pats no reakcijas sākuma līdz beigām. Šo principu atklāja Antuāns Lavuazjē (Antoine Lavoisier), par kuru vairāk varat uzzināt mūsu rakstā par ievērojamākajiem ķīmiķiem.
Ir ļoti svarīgi atzīmēt, ka ķīmiskās reakcijas atšķiras no fiziskām pārmaiņām. Galvenā atšķirība ir tā, ka ķīmiskajā reakcijā atomi veido jaunus produktus, molekulas un savienojumus, kamēr fiziskās pārmaiņas saglabā atomu sākotnējo kārtību. Molekulārās pārmaiņas parasti nav redzamas ar aci, taču ir pazīmes, kas ļauj tās pamanīt – piemēram, temperatūras izmaiņas, burbuļi vai krāsas maiņa. Atomi un molekulas, kas mijiedarbojas, tiek saukti par reaktantiem, bet atomi un molekulas, kas veidojas reakcijas rezultātā, tiek saukti par produktiem. Ķīmisko reakciju vienādojumu var pierakstīt šādi:

Savukārt tie, kas apguvuši ķīmiju un pārvalda pamatzināšanas ķīmijā par ķīmiskajām reakcijām, var pierakstīt to īsākā formā:
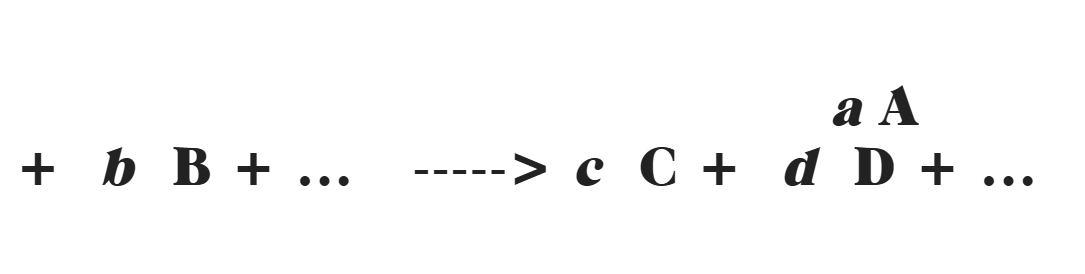
Ķīmiskās reakcijas iedala četros galvenajos veidos:
- sintēze vai tieša kombinācija;
- sadalīšanās (dekompozīcija);
- vienkārša aizvietošana;
- metateze vai dubultā aizvietošana.
Ir tik daudz piemēru ķīmiskajām reakcijām, ko jūs varat novērot ikdienā:
- ugunskura iedegšana vai liesmas radīšana;
- kūku vai citu ceptu ēdienu gatavošana;
- olas vārīšana, cepšana vai maisīšana;
- banānu pūšana;
- hamburgera gaļas grilēšana.
Tas, ko mēs apskatījām šeit, ir tikai aisberga redzamā daļa. Ķīmiskās reakcijas ir plaša tēma, un tās apgūšana sniedz dziļāku izpratni par vielu uzbūvi un dabas likumiem ķīmijā. Ja jūs vēlaties padziļināt zināšanas, iesakām apmeklēt informatīvos resursus par šo tēmu.

Elementi un periodiskā tabula: pamatzināšanas ķīmijā
Ķīmiskais elements ir tīra viela tās vienkāršākajā formā, ko nevar sadalīt tālāk. Zinātnieki līdz šim atklājuši 118 ķīmiskos elementus. No tiem 94 elementi parasti sastopami dabā, bet pārējie 24 ir sintētiski, cilvēka radīti elementi.
Visbagātīgākais elements Visumā ir ūdeņradis, bet uz Zemes – dzelzs. Gan cilvēka ķermenī, gan Zemes garozā visbiežāk sastopamais elements ir skābeklis. Katra elementa struktūra sastāv no viena atoma, un to raksturo protonu skaits atoma kodolā. To sauc par atomu skaitli (Z). Elementi tīrā formā satur vienādu protonu skaitu. Savukārt sajauktie elementi satur dažādu atomu un protonu kombinācijas. Ir tikai daži elementi, kas pilnīgi tīri un nesajaukti pastāv dabā. Šeit ietilpst, piemēram, varš, sudrabs, zelts un sērs. Piemērs sajauktam elementam ir atmosfēras gaiss, kas ir slāpekļa, skābekļa un argona maisījums.
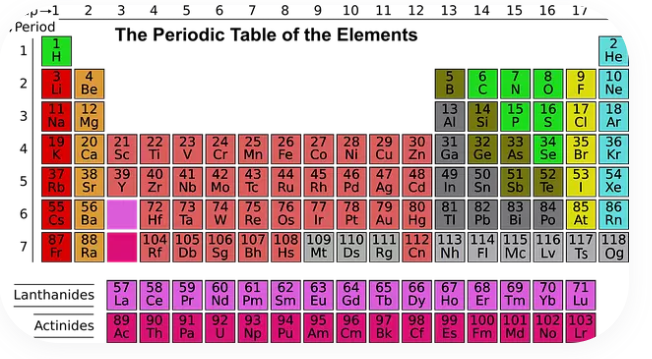
Dažādi elementi ir parādīti periodiskajā tabulā. Pirmais elements ar vienu protonu ir ūdeņradis. Otrais ir hēlijs ar diviem protoniem, bet trešais – litijs ar trim protoniem. Šādi elementi turpinās līdz 118. elementam – oganessonam. Periodiskā tabula ir visbiežāk izmantotā elementu sistēma. Elementi tiek organizēti pēc atomu skaita, elektronu konfigurācijas un atkārtotām ķīmiskām īpašībām. Tabulas rindas sauc par periodiem, bet kolonnas – par grupām. Periodiskajā tabulā ir 18 grupas vai kolonnas, kas apvieno elementus ar līdzīgām ķīmiskajām īpašībām. Tikai septiņām no šīm grupām piešķirts nosaukums:
| 1 | Sārmu metāli | Ļoti reaģējoši metāli, piemēram, nātrijs un kālijs |
| 2 | Sārmainie zemes metāli | Mazāk reaģējoši metāli, piemēram, kalcijs un magnijs |
| 15 | Pnictogēni | Elementi ar dažādām īpašībām, piemēram, slāpeklis un fosfors |
| 16 | Hlorogēni | Reaktīvi nemetāli, piemēram, sērs, selēns, telūrs |
| 17 | Halogēni | Ļoti reaģējoši nemetāli, piemēram, fluors, hlors, broms |
| 18 | Inertās gāzes | Stabilas gāzes, piemēram, neons un argons |
Elementu fona krāsas parāda, vai elements ir metāls, nemetāls vai metaloīds. Krāsas nav standartizētas un bieži tiek pielāgotas pēc vizuālās izvēles, tomēr kategorijas saglabājas nemainīgas. Iepazīšanās ar periodisko tabulu ir aizraujoša un palīdz labāk izprast elementu īpašības, vielu uzbūvi un to lomu ķīmiskajās reakcijās.
Ķīmiskās saites un Levinsa struktūra: pamatzināšanas ķīmijā
Ķīmiskā saite ir pievilkšanās starp atomiem, joniem un molekulām, kas ļauj veidoties ķīmiskajiem savienojumiem. Saites var būt dažāda stipruma – spēcīgākās ir kovalentās, jonu un metāliskās saites, savukārt vājākās ir dipola-dipola mijiedarbība, Londona dispersijas spēks un ūdeņraža saites. Spēcīgās saites, kas satur molekulas kopā, tiek uzskatītas par pastāvīgām, savukārt vājās saites ir īslaicīgas un ar laiku pārtrūkst. Neatkarīgi no saites stipruma, tās ir būtiskas mūsu ķermeņa ķīmijai un dzīvībai kopumā.
Zinātnieki atklājuši, ka galvenais iemesls, kāpēc veidojas ķīmiskās saites, ir, ka atoms cenšas sasniegt savu visstabilāko enerģijas līmeni. Gan ķīmijā, gan dzīvē pretstati piesaista viens otru. Pievilkšanās starp negatīvi lādētajiem elektroniem, kas riņķo ap kodolu, un pozitīvi lādētajiem protoniem kodolā rada spēku, kas veido ķīmisko saiti.
Atomi veido saites, lai sasniegtu stabilāko enerģijas līmeni. Spēcīgās saites veido pastāvīgus savienojumus, vājās – īslaicīgas mijiedarbības. Visi procesi ir būtiski vielu uzbūvei un ķīmiskajām reakcijām.
Ir vairāki ķīmisko saišu veidi:
- jonu saites: veidojas starp pretēji lādētiem joniem. Piemērs – galda sāls (NaCl), kur nātrija joni (+) un hlorīda joni (−) piesaistās viens otram,
- kovalentās saites: atomi kļūst stabilāki, daloties elektronos, nevis tos zaudējot vai iegūstot. Kovalentās saites ir biežāk sastopamas dzīvo organismu molekulās nekā jonu saites. Jo vairāk elektronu tiek koplietoti starp diviem atomiem, jo stiprāka ir kovalentā saite,
- polārās kovalentās saites: elektronus šajā saitē atomu starpā dalās nevienlīdzīgi, un tie vairāk laika pavada pie viena atoma. Elektronu nevienmērīgā sadale izraisa nelielas lādiņu atšķirības molekulā,
- nepolārās kovalentās saites: veidojas starp diviem vienāda elementa atomiem vai starp atomiem, kas vienādi dalās elektronos,
- ūdeņraža saites: veidojas starp polārām kovalentām saitēm, kurās ir ūdeņradis. Elektronu vilkšana uz citu elementu padara ūdeņradi nedaudz pozitīvu, un tas pievelkas pie negatīvi lādētiem atomiem. Šo pievilkšanos sauc par ūdeņraža saiti.
Šīs saites ir fundamentālas vielu uzbūvei, ķīmiskajām reakcijām un vispārīgajiem dabas likumiem ķīmijā, un tās ir pamatzināšanas, kas ļauj saprast molekulārās struktūras un savienojumu īpašības.
Levinsa punktu struktūra: pamatzināšanas ķīmijā
Levinsa punktu struktūras parāda, kā atomi un molekulas veido saites, kā arī kur atrodas brīvie elektronu pāri molekulā. Šo struktūru 1916. gadā ieviesa Gilberts N. Lūiss (Gilbert N. Lewis) rakstā “Atoms un Molekula”. Levinsa punktu struktūra attīstīja elektronpunktu diagrammu, pievienojot līnijas, kas attēlo koplietotos elektronus ķīmiskajā saitē. Tas ir ātrs un vienkāršs veids, kā parādīt valences elektronus atsevišķos atomos, kad vēl nav veidotas saites vai savienojumi. Šī metode palīdz labāk izprast vielu uzbūvi, molekulāro struktūru un ķīmiskās reakcijas, kas ir pamatzināšanas ķīmijā.
| H₂O | H–O–H : | 2 pāri | Polāra molekula |
| CO₂ | O=C=O | Nav pāru | Nepolāra molekula |
| NH₃ | H–N:–H | 1 pāris | Polāra molekula |
- Līnijas (–) attēlo koplietotos elektronus (kovalentās saites).
- Punkti (:) attēlo brīvos elektronus.
- Šī tabula palīdz ātri saprast vielu uzbūvi, elektronus valences līmenī un to, kā molekulas uzvedas ķīmiskajās reakcijās.
Skābuma un sārmainības pamatzināšanas ķīmijā
Vielas var būt gan skābas, gan sārmainas. Skābuma–sārmainības reakcija ir parasta ķīmiskā reakcija starp skābi un sārmu. To bieži izmanto, lai noteiktu vielas vai šķīduma pH līmeni. Daudzi zinātnieki ir izstrādājuši savas skābuma–sārmainības teorijas, lai precīzi aprēķinātu pH, pareizi definētu vielas un rūpīgi novērotu ķīmiskās reakcijas. Ar kvalificēta ķīmijas skolotāja vai pasniedzēja palīdzību jūs varat viegli pārvarēt pat sarežģītākās tēmas, labāk izprotot vielu uzbūvi, dabas likumus ķīmijā un pamatzināšanas par ķīmiskajām reakcijām.
Viela ir skāba, ja tā dod protonus (H⁺) reakcijā, un sārmaina, ja tā pieņem protonus vai atbrīvo OH⁻ jonus. Skābuma un sārmainības reakcijas ļauj noteikt vielas pH un ir būtiskas ķīmiskajās reakcijās un vielu uzbūves izpratnē.
Svante Arhenija skābju un bāzu teorija: pamatzināšanas ķīmijā
Šī skābju teorija radusies 1884. gadā un joprojām ir viena no biežāk lietotajām ķīmijā. Svante Arhenijs lielāko daļu savas darba dzīves pavadīja, novērojot sāļus un to pārmaiņas ūdenī.
Saskaņā ar Arhenija teoriju:
- Reakcijām nepieciešams ūdens (šķīdums).
- Tikai protonu skābes ir atļautas, jo tās rada ūdeņraža jonus (H⁺).
- Tikai hidroksīda bāzes ir atļautas, jo tās rada OH⁻ jonus šķīdumā.
- Skābes šķīdumā rada H⁺ jonus, bet bāzes – OH⁻ jonus.
Šī teorija ir būtiska, lai izprastu ķīmiskās reakcijas, vielu uzbūvi un pamatzināšanas ķīmijā par skābēm un bāzēm.
Gilberta Ņūtona Lūisa skābju un bāzu teorija: pamatzināšanas ķīmijā
Šī teorija tiek uzskatīta par vismazāk stingro skābju teoriju, jo tajā tiek pētīti tikai elektronu pāri, bet protoni tiek pilnībā ignorēti.
Galvenie principi:
- Skābes ir elektronu pāru pieņēmēji.
- Bāzes ir elektronu pāru donori.
Šī pieeja ļauj labāk izprast vielu uzbūvi, ķīmiskās reakcijas un fundamentālās pamatzināšanas ķīmijā, īpaši attiecībā uz molekulārajām saitēm un mijiedarbībām.
Brønsteda–Lovrija skābju teorija: pamatzināšanas ķīmijā
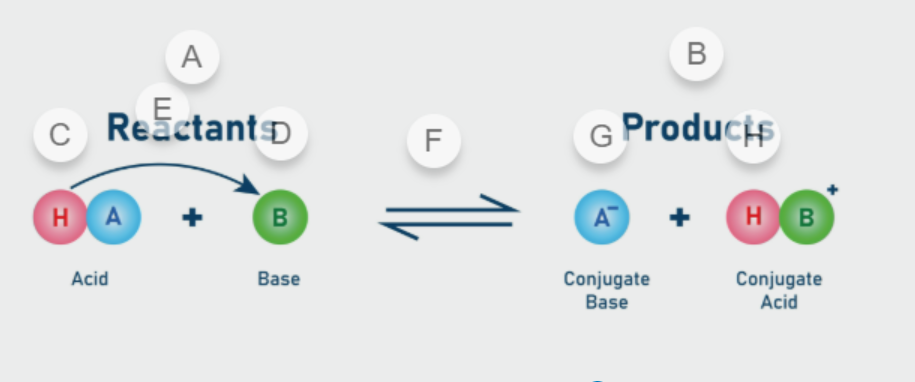
Saskaņā ar Brønsteda–Lovrija teoriju skābju–bāzu reakcijas tiek aprakstītas kā:
- skābe atbrīvo protonu (H⁺),
- bāze šo protonu pieņem.
Galvenās teorijas īpašības:
- skābes ir protonu donori, bāzes – protonu akceptori;
- ūdens šķīdumi ir pieņemami;
- bāzes var būt ne tikai hidroksīdi;
- tikai protonu saturošas skābes ir pieņemtas.
Skābju pazīmes:
- skāba vai rūgtena garša,
- korozīvs efekts,
- ūdens šķīdumi vada elektrību,
- reakcija ar bāzēm veido sāļus un ūdeni.
Bāzu pazīmes:
- rūgtena garša,
- nemaina lakmusa krāsu (zils augu pigments).
Ikdienā bieži sastopamas skābes:
- citrona skābe, pienskābe, etiķskābe, ogļskābe, askorbīnskābe.
Biežāk sastopamās bāzes:
- mazgāšanas līdzekļi, ziepes, nātrija hidroksīds (lauga), mājas amonjaks.
Ķīmija ir daudzveidīga un aizraujoša zinātne. Pamata jēdzienus jūs varat izpētīt arī mājās, un, ja interesējaties par zinātni, ķīmija ir lieliska izvēle. Papildus varat iepazīt svarīgākos ķīmijas atklājumus, pārsteidzošos ķīmijas faktus un būtisko ķīmijas aprīkojumu ar Superprof palīdzību.
Rezumēt ar MI















